본 발명은 최적기의 개과 동물의 체세포를 공여 핵 세포로 이용하여 개선된 수율로 개과 동물을 복제하는 방법을 제공함으로써, 의약학, 수의학 분야에서 복제 개과 동물을 이용한 약제 또는 장기 등의 생산 등과 관련된 무한한 응용가능성이 있으며, 본 발명에 따라 복제 개과 동물을 생산하는 기술은 반드시 개과 동물에 국한되지 않고 향후의 광범위한 시도에 따라 변형되어 상이한 종의 동물들에도 적용될 수 있을 것이다.
복제견의 성공적인 생산법이 보고되어 있지만, 효율은 여전히 낮다. 복제견 배아의 IVC(in vitro culture) 시스템이 확립되지 않아 복제 개 배아의 생체외 발달능을 분석하는데 어려움이 있다.
상기 기술을 확립하기 위해 다양한 노력이 진행되어 왔지만, 효율은 크게 개선되지 못하고 있다.
많은 인자들이 SCNT(somaticcell nuclear transfer)의 효율에 잠재적으로 영향을 미칠 수 있으며, 이 중 일부가 개의 SCNT 배아의 발달에서 성공적으로 보고되었다.
상기 인자는 수령 세포질인 생체내 난자의 수집, 핵 공여를 위한 체세포의 준비, 이용된 SCNT 과정, 융합/활성화 및 ET(embryonic transfer)를 포함한다.
상기 인자들이 최적화된다면, SCNT 복제견이 고효율로 생산될 수 있다.
지금까지, SCNT 복제견은 공여 핵의 준비를 제외한 난자 수집 방법, SCNT 절차 및 융합과 활성화 분야를 최적화함에 의해 생산되었다.
소와 돼지의 SCNT와는 달리, SCNT 복제견의 생산에서 공여 핵의 세포 주기 및 준비에 대한 분석은 거의 이루어지지 않고 있다. SCNT 복제견 연구에서 공여핵은 가장 중요한 요인일 것으로 여겨지고 있지만, 간과되어 왔다.
비 녹색 형광성 단백질 (GFP)로 형질전환된 세포가 SCNT에서 공여 핵으로 이용될 경우에는, SCNT 효율이 공여 세포 주기 단계에 의존적임에도 불구하고, 그들의 세포 주기 단계 또는 생존능을 확인할 수 있는 방법이 없었다.
Boquest 등은 세포 주기 단계에 따라 공여 핵의 DNA 함량이 달라짐에 따라 의심할 여지없다고 보고 였다.
Wilmut 등은 혈청 기아(serum starvation)로 공여 핵을 G0에 동기화하는 것이 SCNT로 복제 양을 생산하는데 중요함을 보고하였다.
Cibelli 등은 G1 단계 비정지(nonquiescent) 태아 섬유아세포로부터 형질전환 소를 복제할 수 있었다.
돼지의 SCNT 배아를 생산함에 있어 혈청 기아에 의한 세포 주기 동기화는 실제 필요치 않은 것으로 확인되었다.
Khammanit가 개 피부 섬유아세포의 세포 주기 동기화에 대한 혈청 기아와 화합물 억제제의 효과에 대하여 시험관내 결과를 보여주었음에도 불구하고, SCNT 절차 자체를 수행하지 않았기 때문에SCNT 효율을 평가할 수 없다.
SCNT의 효율에 세포 주기의 동기화 뿐만 아니라 공여 세포의 영향이 조심스럽게고려되었다.
그러나, 공여세포 계대의 효과에 대하여 이견이 존재하는 상황이다.
본 발명의 목적은 최적기의 개과 동물의 체세포를 공여 핵 세포로 이용하여 개과 동물의 핵 이식란을 생산하는 방법 및 이에 의해 제조된 개과 동물의 핵 이식란을 제공하는 것이다.
또한, 본 발명의 다른 목적은 상기 방법에 의해 제조된 핵 이식란을 대리모에 이식하여 산자를 출생하는 단계를 포함하는 복제된 개과 동물의 생산방법 및 이에 의하여 생산된 복제된 개과 동물을 제공하는 것이다.
특허 기술 설명
본 발명은 개과 동물의 복제방법에 관한 것으로, 보다 구체적으로 본 발명은 개과동물의 생체로부터 회수된 성숙 난자로부터 탈핵 난자를 제조하고, 최적기의 개과 동물의 체세포를 공여 핵 세포로 이용하여, 상기 탈핵 난자에 핵 이식을 수행하여 핵 이식란을 제조하고, 이를 대리모의 난관에 이식하여 개과 동물을 복제해 내는 방법 및 상기 방법에 의해 생산된 복제된 개과 동물에 관한 것이다.
본 발명의 목적은 최적기의 개과 동물의 체세포를 공여 핵 세포로 이용하여 개과 동물의 핵 이식란을 생산하는 방법 및 이에 의해 제조된 개과 동물의 핵 이식란을 제공하는 것이다.
또한, 본 발명의 다른 목적은 상기 방법에 의해 제조된 핵 이식란을 대리모에 이식하여 산자를 출생하는 단계를 포함하는 복제된 개과 동물의 생산방법 및 이에 의하여 생산된 복제된 개과 동물을 제공하는 것이다.
본 발명에 따른 개과동물의 핵 이식란을 생산하는 방법
제1단계: 수핵 난자의 탈핵
개과 동물은 다른 포유동물의 경우와는 달리 배란 후 수시간 동안 난관에 머물면서 미성숙 난자가 성숙 난자가 된다.
포유동물의 경우 난자는 성숙 난자, 즉 제2차 감수분열 중기(metaphase II)에 배란이 되는데 반해, 개과 동물의 난자는 제1차 감수분별 전기에 배란되어 난관 내에서 48-120시간 동안 머물면서 성숙과정을 거치는 것이 특징이다.
이러한 특징적인 번식 생리와 더불어 많은 연구진들의 연구(Lee et al, Reprod. Domest. Anim., 42(6):561-5, 2007; Lee et al, Zygote, 15(4):347-53, 2007)에도 불구하고 개과 동물에 있어서 난자의 체외성숙 (in vitro maturation) 효율은 여전히 낮은 편이다.
따라서 개과 동물의 생체 내에서 성숙된 난자를 회수하여 체세포 핵이식의 수핵난자로 사용하는 것이 가장 바람직하다.
성숙난자를 회수하기 위해 개과 동물에 있어서 배란적기를 판단하는 방법은 예를 들면, 이에 한정되지는 않으나 질세포 도말검사를 통해 각화상피세포가 70%이상임을 확인하였을 때를 최적기로 판단하는 방법과 초음파 영상을 통해 난포의 성장과 발육상태를 실시간으로 확인하는 방법 및 혈장 프로게스테론을 측정하여 적기를 판단하는 방법들이 있다.
본 발명에서는 수핵난자를 제공하는 공여견의 혈중 프로게스테론의 농도를 측정함으로써 난자 성숙 정도를 판단하는 것이 바람직하다.
바람직하게는 혈장 프로게스테론 농도가 4.0~7.5ng/mL일 때를 배란일로 간주하여 난자를 회수한다.
특히, 난자의 혈장 프로게스테론이 급하게 상승(≥3.6ng/ml/day) 하는 개체들의 경우 배란일로부터 70-80시간째 (성숙 수핵난자 회수율 87.6%) 회수하는 것이 최적기이고, 천천히 상승 (<3.6ng/ml/day)하는 개체들의 경우 배란일로부터 80-90시간째 (성숙 수핵 난자 회수율 69.6%) 회수하는 것이 가장 바람직하다.
이는 개체별로 프로게스테론의 증가 속도에 차이가 있기 때문이다.
또한, 생체 내 성숙 난자를 회수하는 방법으로는 대상 동물을 마취한 후 개복시키는 것을 포함하는 외과적 방법을 사용할 수 있다.
보다 구체적으로, 생체 내 성숙 난자의 회수는 당업계에 공지된 방법인 난관 절제법을 사용할 수 있다.
상기 난관 절제법은 난관을 수술적으로 잘라낸 후 배아 수집 배지를 난관 내부에 관류시켜 관류액을 수득하고 상기 관류액으로부터 난자를 회수하는 방법이다.
또한, 생체 내 성숙 난자는 카테터를 난관채에 장착한 후 난관-자궁 접합부위에 주사침을 이용하여 관류액을 주입함으로써 회수할 수 있다.
이 방법은 난관을 손상시키지 않기 때문에 난자를 공여하는 동물을 다음 발정에도 이용할 수 있다는 장점이 있다.
따라서, 바람직하게는 생체 내 성숙 난자의 회수는 난관을 손상시키지 않는 카테터를 이용한 방법을 사용한다.
보다 바람직하게는, 카테터를 이용한 난자 회수 방법에 있어서, 본 발명자들이 개발한 니들의 앞부분이 둥글게 처리되어 있어 난관 입구에 장착이 용이한 16 게이지 존대(Zondae)를 이용하여 난자를 회수할 수도있다.
이 방법은 앞부분이 둥글게 처리된 난자 회수용 니들을 난관 내에 삽입-결찰한 후 난관-자궁 접합부에 난자회수용 배지를 관류시켜 상기 난자 회수용 니들에 관류액이 유입되도록 하고 상기 관류액을 현미경으로 검경하여 성숙한 난자를 수득하는 방법이다.
성숙한 난자를 회수한 다음에는 난자의 반수체 핵을 제거하여 탈핵난자를 제조한다.
난자의 탈핵은 당업계에 공지된 방법을 사용하여 수행할 수 있다(미국특허 제4994384호, 미국특허 제5057420호, 미국특허 제5945577호, 유럽특허 공개공보 제0930009A1, 대한민국특허 제342437호, Kanda et al, J. Vet. Med. Sci.,57(4):641-646, 1995; Willadsen, Nature, 320:63-65, 1986, Nagashima et al., Mol. Reprod. Dev. 48:339-343 1997; Nagashima et al., J. Reprod Dev 38:37-78, 1992; Prather et al., Biol. Reprod 41:414-418,1989, Prather et al., J. Exp. Zool. 255:355-358, 1990; Saito et al., Assis Reprod Tech Andro, 259:257-266, 1992; Terlouw et al., Theriogenology 37:309, 1992).
바람직하게는, 수핵 난자의 탈핵은 크게 두 가지 방법을 사용하여 수행할 수 있다.
한 가지 방법으로는 성숙한 수핵 난자의 난구 세포(cumulus cell)를 제거한 다음, 미세침을 이용하여 수핵 난자의 투명대 일부를 절개하여 절개창을 형성하고 이를 통하여 제1극체, 난자의 핵 및 세포질(가능한 적은 양)을 제거하는 것이다.
다른 방법으로는 수핵 난자의 난구 세포를 제거한 다음 난자를 염색하고 미세 흡입 피펫(aspiration pipet)을이용하여 제1극체 및 난자의 핵을 제거하는 것이다.
보다 바람직하게는, 난자에 절개창을 형성하여 쥐어짜기 (Enucleation; Squeezing method)방법으로 탈핵한다.
이는 홀딩 마이크로 피펫으로 수핵 난자를 고정한 후 제1극체와 난자 핵 그리고 일부 세포질을 제거하는 방법으로 수행한다.
보다 구체적인 방법은 이하와 같다.
예를 들어, 절개한 난자를 회전시켜 절개창을 수직으로 위치시킨후 고정용 피펫을 난자의 밑 부위에 위치시켜 난자가 아래쪽으로 움직이지 못하도록 받친 뒤 절개 피펫을 난자의 위에서 눌러 제 1극체를 포함하여 세포질을 10~30% 탈핵을 실시한다.
또는 난자의 절개창을 3시 방향에서 수직으로 회전시킨 후 고정용 피펫과 절개 피펫을 아래 위에서 눌러서 제 1극체를 포함하여 세포질의 10~30% 탈핵을 실시한다.
탈핵시킨 1군의 난자는 TCM-W로 3회 세정하고 핵이식 전까지 IVM용 TCM 199(B-①)에 정치시킨
다.
탈핵 후의 난자는 매우 취약하기 때문에 마우스 피펫은 최소한 내경이 300㎛ 이상 되는 것을 사용하여 작업 후 난자의 세포질이 절개창을 통해 빠져나오지 않도록 주의한다.
제2단계: 공여 핵 세포의 제조
공여 핵 세포로는 개과 동물로부터 유래된 체세포가 사용될 수 있다.
구체적으로, 본 발명에서 사용된 체세포로는 개과 동물의 배아세포(embryonic cell),태아세포(fetus cell), 유세포(juvenile cell), 성체세포(adult cell), 바람직하게는 성체세포로부터 수득될 수 있는 난구, 피부, 구강 점막, 혈액, 골수, 간, 폐,신장, 근육 및 생식기관 등과 같은 형태의 조직으로부터 유래된 것일 수 있다.
본 발명에서 사용될 수 있는 체세포로는 예를 들면, 이에 한정되지는 않으나 난구세포, 상피세포, 섬유아세포, 신경세포, 각질세포, 조혈세포, 멜라닌 세포, 연골세포, 적혈구, 마크로파지, 단구세포, 근육세포, B림프구, T 림프구, 배아 줄기세포, 배아 생식세포, 태아세포, 태좌세포 및 배아세포 등이 있다.
보다 바람직하게, 본 발명에서 사용되는 체세포로는 태아 및 성체 섬유아세포, 난구세포일 수 있다.
나아가, 본 발명에서 사용되는 공여 핵 세포는 상기 야생형 체세포에 특정 유전자를 삽입하거나 조작하여 염색체를 유전자 이식방법이나 유전자 적중법을 이용하여 형질전환시킨 것일 수 있다.
상기 유전자 이식방법이나 유전자 적중법은 당업계에 공지된 방법이므로 당업자라면 용이하게 실시할 수 있다.
공여 핵 세포로서 제공되는 체세포는 외과용 표본 또는 생체검사용 표본을 제조하는 방법으로부터 수득될 수 있으며 상기 표본으로부터 공지된 방법을 사용하여 단일세포를 수득할 수 있다.
예를 들면, 대상동물로부터 조직의 일부를 무균적으로 절개하여 상기 외과용 표본 또는 생체검사용 표본을 수득하고 이를 미세하게 세절 하여 콜라게나제로 처리한 다음 조직 배양용 배지에서 배양한다.
조직 배양용 배지에서 3~4일 배양 후에 배양접시(dish)에 자라는 것을 확인하고, 완전히 다 자라면 일부는 추후 사용을 위하여 동결하여 액체 질소에 보관하며, 나머지는 핵 이식에 이용하기 위하여 계속 배양을 실시한다.
상기에서 조직 배양용 배지로는 당업계에 공지된 것을 사용할 수 있으며 예를 들면, TCM-199, DMEM(Dulbecco's modified Eagle's medium) 등이 있다.
일반적으로, SCNT를 위해서는 공여 핵 세포를 G0/G1 단계에 동기화(synchronization)하는 것이 필요하다.
이를 위해, 특정 화합물의 처리, 접촉 억제(contact inhibition) 또는 혈청 기아(serum starvation)와 같은 인공적 동기화 방법이 이용되어 왔다.
그러나, 인공적 동기화 방법은 세포의자연살해사(apoptosis), 퇴화(degeneration) 및 SCNT 후 배아의 발달정지(developmental block)를 증가시킬 수 있다. 이에, 본 발명자는 상기 문제점을 극복하기 위해 인공적으로 동기화 처리를 하지 않고 공여 핵 세포의자연적인 세포주기 상태에서 인공적 동기화 처리와 동일한 세포주기 분포양상을 분석한 공여 핵 세포를 고 수율로 얻을 수 있는 방법을 연구하였다.
본 발명자는 혈청 기아 또는 접촉 억제에 의해 동기화 처리를 한 공여 핵 세포와 1 내지 5일 동안, 바람직하게는 2~4일 동안 배양된 공여 핵 세포에서 G0/G1 단계에 있는 세포의 비율이 유사함을 확인하였다.
따라서, 본 발명에서 공여 핵 세포는 개과 동물의 조직으로부터 분리된 후 또는 계대 후 3 내지 5일 동안, 바람직하게는 4일 동안 배양된 것이 바람직하다.
또한, 상기 공여 핵 세포는 계대 회수가 10회 이하, 바람직하게는 계대 회수가 6회 이하인 것이 적합하다.
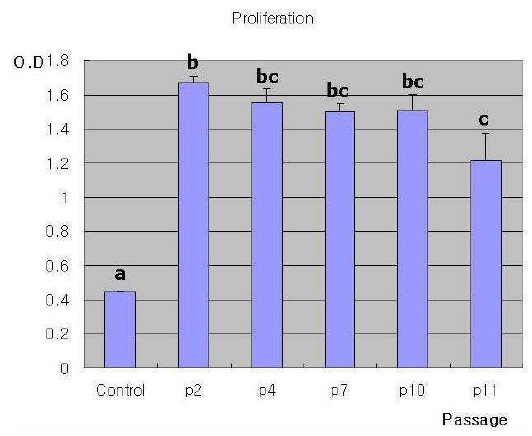
본 발명의 실시예에서는, 11계대 후에는 세포의 증식율이 낮아지고, 10계대 후에는 세포의 자연살해사가 증가하며, 7 계대 후에는 G0/G1 단계에 있는 세포의 비율이 감소함을 확인하였다
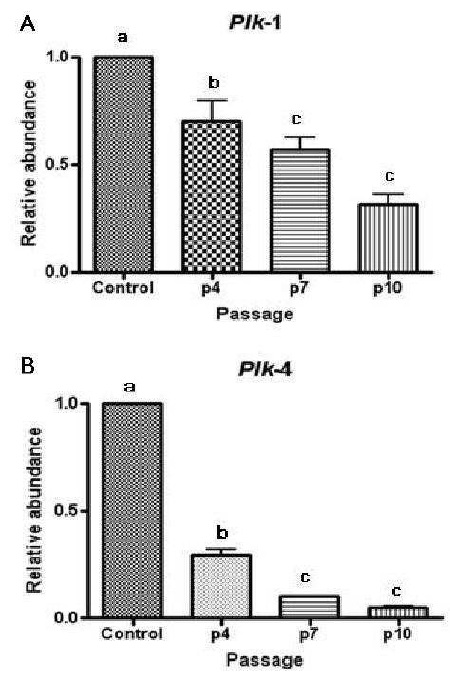
본 발명에서는 SCNT에 적절한 공여 핵 세포를 선택하기 위하여, 공여 핵 세포의 Plk-1 또는 Plk-4 유전자의 발현양을 확인하는 것이 바람직하다.
일반적으로 계대 회수가 4회 이하인 최적기의 공여 핵 세포는 Plk-1또는 Plk-4 유전자의 발현 양이 계대회수가 7회 이상인, 바람직하게는 계대회수가 7회인 세포를 기준으로 Plk-1의 경우, 1.2 ~ 2.2배, Plk-4의 경우, 3.2 ~ 6.4배인 것이 바람직하다
제3단계: 공여 핵 세포의 미세주입 및 융합/활성화
탈핵 난자에 공여 핵 세포의 미세주입은 이식용 피펫을 사용하여 공여 핵 세포를 탈핵 난자의 세포질과 투명대 사이에 주입함으로써 수행할 수 있다.
상기 공여 핵 세포의 미세주입이 완료된 탈핵 난자는 세포 조작기를 이용하여 전기적으로 공여 핵 세포와 융합시킨다.
전기적 융합에서 전류는 교류 또는 직류일 수 있으며, 바람직하게는 전압 1.3~2.3kV/cm 조건으
로 수행할 수 있다.
보다 바람직하게는 직류전압 1.3~2.3kv/cm로, 바람직하게는 1.5~2.0kv/cm로, 가장 바람직하게는
1.9kv/cm로, 15~45㎲ 동안 1-3회 수행할 수 있다. 1회 통전에 의해 융합이 이루어지지 않은 경우에, 동일한 전압과 시간 조건으로 추가로 전기 융합을 수행하는 것이 바람직하다.
공여 핵 세포와 난자의 전기적 자극에 의한 융합은 융합용 배지 내에서 수행할 수 있다. 상기 융합용 배지로는 만니톨, MgSO4, 헤페스(Hepes)가 혼합된 배지를 사용할 수 있다.
바람직하게는 0.1~0.5 M 만니톨, 0.05~0.2 mM MgSO4, 0.1~1.0 mM 헤페스가 혼합된 배지에서 수행될 수 있다.
제4단계: 융합된 핵 이식란의 활성화
융합된 핵 이식란의 활성화는 체외성숙단계에서 제2감수분열 중기에 멈추어있는 세포주기를 재개시키는 과정을 의미한다.
이를 위해서는 세포주기를 정지시키는 물질인 MPF, CSF 등의 높은 활성도는 낮추고, 제2감수분열 중기에서 후기로 전이를 촉진하는 APC의 낮은 활성도는 높여주어야 한다.
일반적으로 핵 이식란을 활성화시키기 위해서는 세포 내 Ca2+ 이온의 농도를 증가시켜 염색체 응축과 배아발달을 유도해야 하며, 이를 위해 물리적인 방법, 화학적인 방법, 또는 전기적인 방법이 사용된다.
물리적인 방법으로는 기계적인 자극, 열, 그리고 직류를 이용하는 방법이 있다. 화학적 방법으로는 에탄올, 이노시톨 트리포스페이트, Ca2+ 또는 Sr2+, 사이토칼라신 B, 칼슘 아이오노포어, 6-디메틸아미노퓨린, 사이클로헥시미드, 그리고 포볼 12-미리스테이트 13-아세테이트와 같은 물질로 처리하는 방법이 있다.
전기적인 활성화 방법으로서, 직류전압 1.3~2.3kV/cm 조건으로 15~45㎲ 동안 1~3회 수행할 수 있다.
본 발명은 상기 핵 이식란을 대리모의 난관에 이식하여 산자를 출생하는 단계를 포함하는 복제된 개과동물의 생산방법을 제공한다.
바람직하게는 상기 개과 동물은 개, 늑대, 여우, 재칼, 코요테, 승냥이 및 너구리로 이루어진 그룹 중에서 선택될 수 있다.
본 발명은 상기 방법에 의하여 생산된 복제된 개과 동물을 제공한다.
[티베탄 마스티프의 성체 피부 섬유아세포의 계대 회수에 따른 증식율]
[티베탄 마스티프의 성체 피부 섬유아세포의 계대 회수에 따른 Plk-1(A) 및 Plk-4(B) 유전자의 발현양]
[SCNT에 의해 생산된 17두의 복제 개를 나타낸 것으로, A는 대조군으로 복제된 개이고, B는 7두의 복제 개이고, C는 9두의 복제 개다]

발명자: 황우석
대리인: 김순웅
|
권 리 란 |
|
표시번호 |
사 항 |
|
1번 |
|
출원 연월일 : |
2009년 08월 13일 |
출 원 번 호 : |
10-2009-0074616 |
|
공고 연월일 : |
2011년 07월 14일 |
공 고 번 호 : |
|
|
특허결정(심결)연월일 : |
2011년 07월 05일 |
청구범위의 항수 : |
4 |
|
유 별 : |
C12N 5/07 |
|
발명의 명칭 : |
개과 동물의 복제 효율을 증가시키는 방법 |
|
존속기간(예정)만료일 : |
2029년 08월 13일 |
|
2011년 07월 06일 등록 | |
|
특 허 권 자 란 |
|
순위번호 |
사 항 |
|
1번 |
|
(등록권리자) |
|
황우석 |
|
|
|
|
2011년 07월 06일 등록 | |
'개과 동물의 복제 효율을 증가시키는 방법' 특허 자세히 보기
